Пространственный транскриптомный анализ гетерогенности опухолевого микроокружения при первичном и метастатическом раке поджелудочной железы
Автор, Злой гений
Я должен сказать, что сейчас наступила эра одноклеточных+.
Сегодняшние ссылки

Были использованы многие методы анализа, используемые на наших космических курсах.
Spotclean + Seurat + гармония + RCTD + Mistyr + анализ ниши + пространственные характеристики микросреды Ecotyper + пространственная кластеризация клеток + совместная локализация + молекулярные различия ниш
Я надеюсь, что все будут усердно учиться и хорошо анализировать пространственные данные, и вы обязательно сможете получить высокие баллы.
Давайте поделимся этой статьей
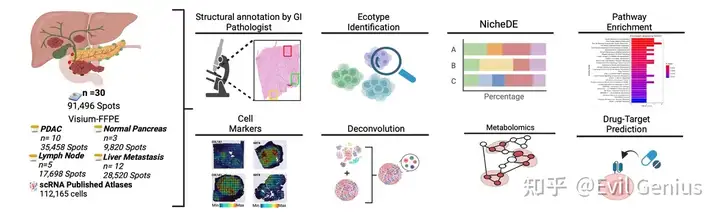
фон знаний
- PDAC является по своей сути агрессивным заболеванием. Лишь около 15% пациентов на момент постановки диагноза имеют резектабельные опухоли; у большинства из них диагностируется местно-распространенное или метастатическое заболевание; Примерно у 50% пациентов на момент постановки диагноза имеются метастазы, причем более 80% метастазов возникают в печени. Хирургическое вмешательство остается единственным методом лечения PDAC.
- Определение пространственной организации опухолевой экосистемы и клеточной динамики, лежащей в основе метастазов, имеет решающее значение для улучшения нашего понимания биологии PDAC и разработки эффективных методов лечения. С помощью интегрированной пространственно разложенной транскриптомики была построена пространственная карта, показывающая различные клеточные состояния и экологическую динамику прогрессирования PDAC.
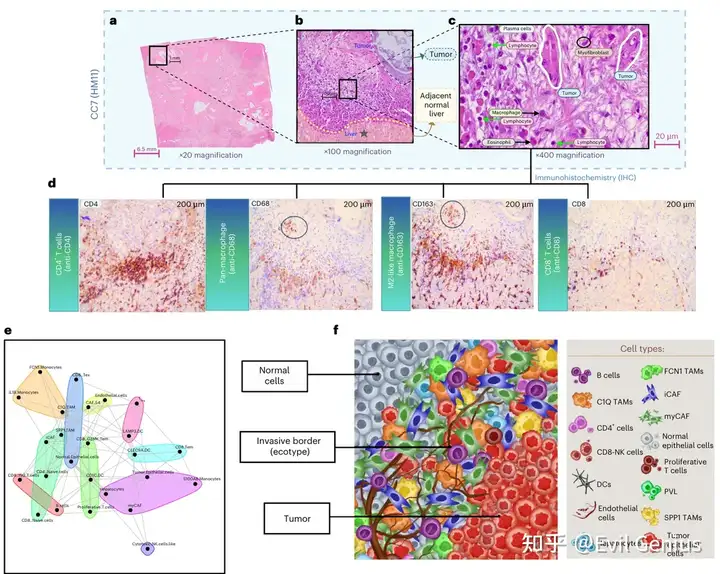
Результаты 1. Карта пространственного транскриптома PDAC (Visium FFPE).
Пространственная аннотация: аннотация гистологической структуры + клеточный маркер + деконволюция пространственных суставов одной клетки (отдельные клетки являются общедоступными данными)
Аннотация клеток в сочетании с нашим пространственным молекулярным атласом позволяет детально изучать опухоли и их микроокружение.

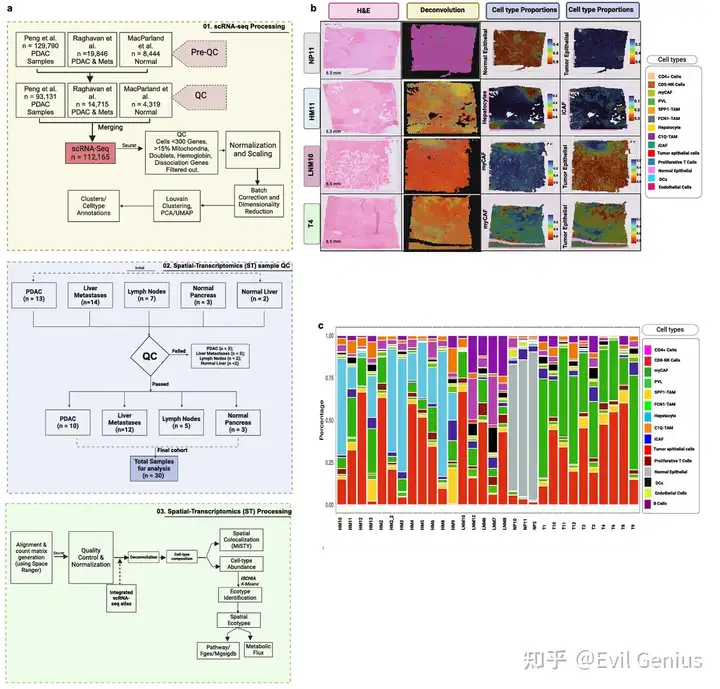
Результаты 2. Пространственная структура рака поджелудочной железы.
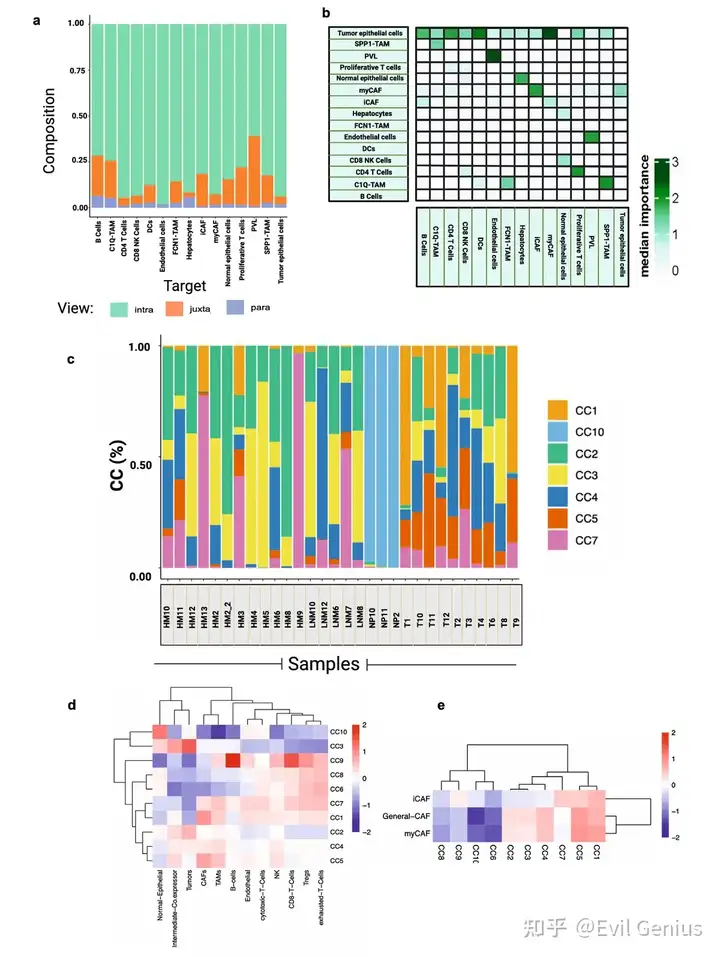
- Примените MISTy, чтобы выяснить, можно ли предсказать количество основных типов клеток в отдельных транскриптомных пятнах на основе их пространственного контекста, определяемого составом типов клеток их микроокружения. Конкретно,Выясните, может ли локальная среда соседних ячеек, характеризующаяся относительными пропорциями типов клеток, определять масштаб пространства внутри пятна (~ 55 мкм), смежного вида (~ 200 мкм; радиус пяти точек) и паравида (~ 3000 мкм; радиус 15 точек).。по всей площади опухоли,отдельная организацияspotвнутренний Совместная локализация взаимодействия (intraview) становится наиболее прогностическим признаком, выявляющим Совместную связь между популяциями злокачественных и неопухолевых клеток. локализация。
- Важность пространственных взаимоотношений между типами клеток в PDAC TME, которые предоставляют потенциальную информацию для понимания биологии опухолей и терапевтических подходов.
- Колокализация опухолевых клеток, иммунных клеток и стромальных клеток подчеркивает потенциал изучения архитектуры опухоли для понимания функциональной роли состояния раковых клеток.
- Нарушение клеточного окружения при раке отражает нарушения в природных экосистемах, влияющие на прогрессирование заболевания и лечение.
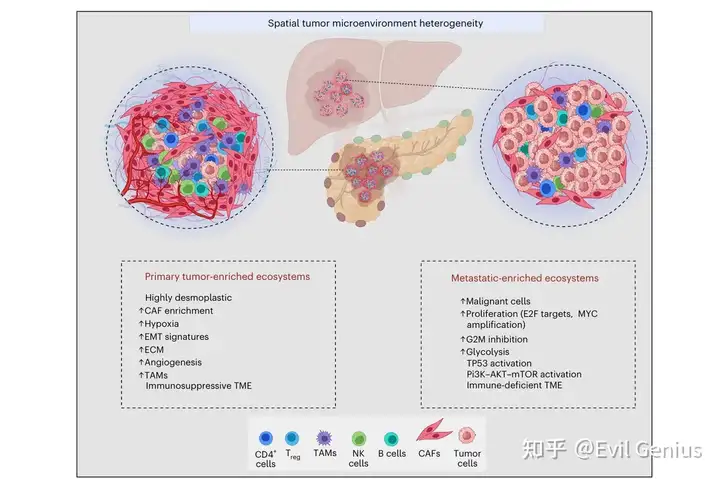
- Интегрированное пространственное картирование выявляет гетерогенность TME при PDAC из-за различного состава популяций злокачественных, стромальных и иммунных клеток в каждом отдельном пространственном местоположении (экотипе).
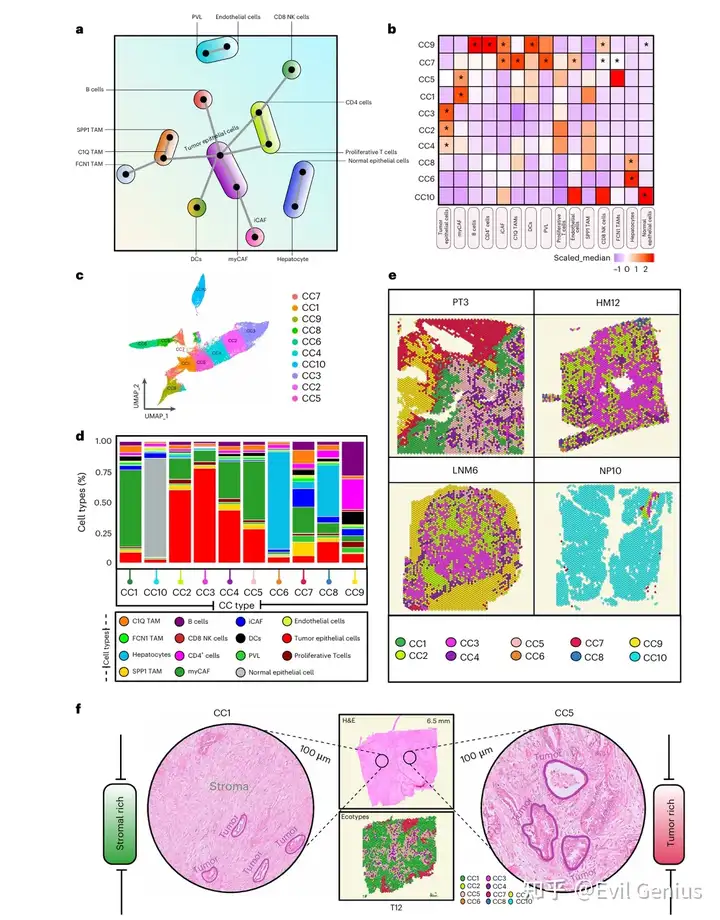
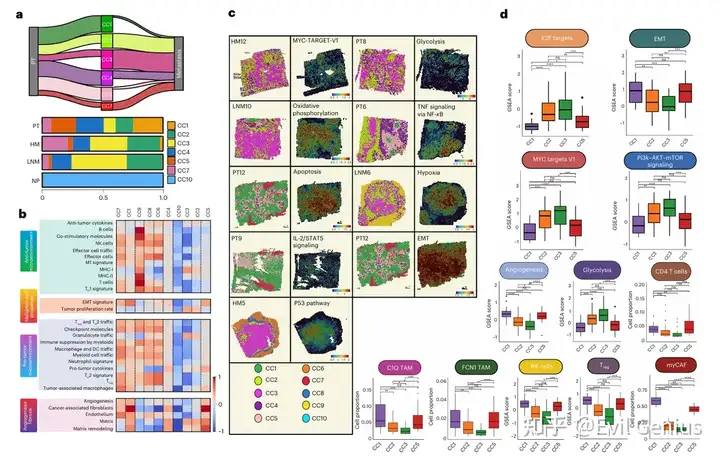
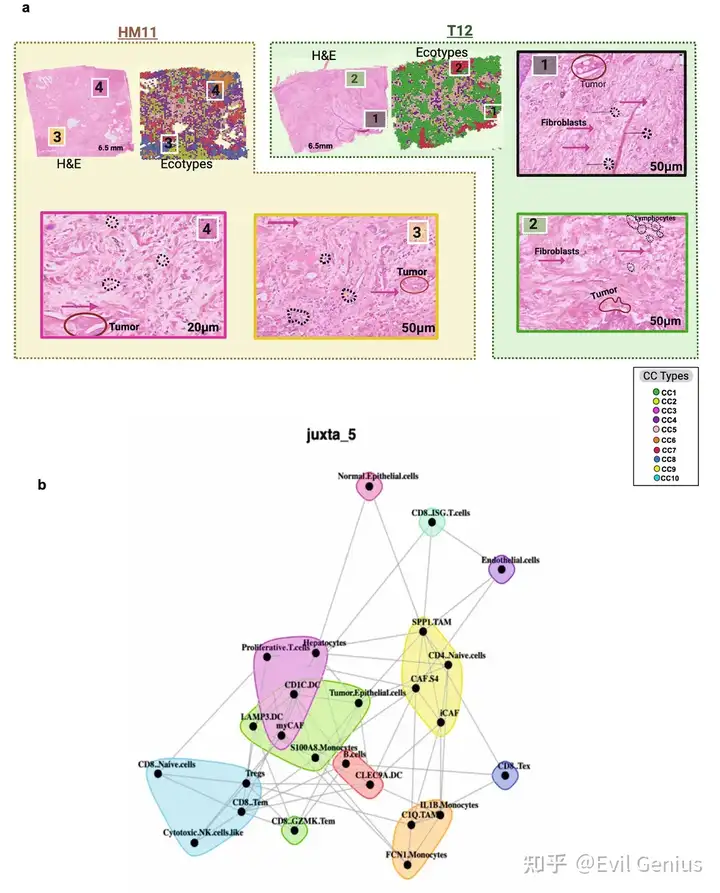
Результаты 3. Структурные вариации экосистемы рака поджелудочной железы.
- Чтобы определить пространственные различия экотипов в прогрессировании PDAC, образцы из разных гистоморфологических регионов сравнивали на молекулярном и композиционном уровнях. Различные закономерности обогащения наблюдались для 5 из 7 связанных с опухолью пространственных экотипов между первичным PDAC и его метастатическими пятнами. В первичных опухолях поджелудочной железы преобладают ниши десмоплазии и гипоксического фиброза (CC1 и CC5), которые богаты отложениями внеклеточного матрикса и плотными стромальными компартментами, в основном состоящими из myCAF, периваскулярно-подобных фибробластов и иммуносупрессивных иммунных клеток. Особенно регуляторные Т-клетки (Treg-клетки) и Tam. Эти наблюдения подтверждают предыдущие выводы о том, что существует подтип «активированного матрикса» в PDAC, который обогащен myCAF, M2-подобными макрофагами и Treg-клетками, а также иммуносупрессивными и десмопластическими свойствами первичного PDAC TME. Анализ обогащения показал, что в этих экотипах преобладали признаки, связанные с ЕМТ, ангиогенезом и адаптивной активацией коагуляционных клеток в ответ на гипоксический стресс.
- Эти результаты подчеркивают сложные, контекстно-зависимые взаимодействия между опухолевыми, стромальными и иммунными компартментами, которые формируют различные пространственные экотипы в экосистеме PDAC, от первичной опухоли до метастатических участков.。
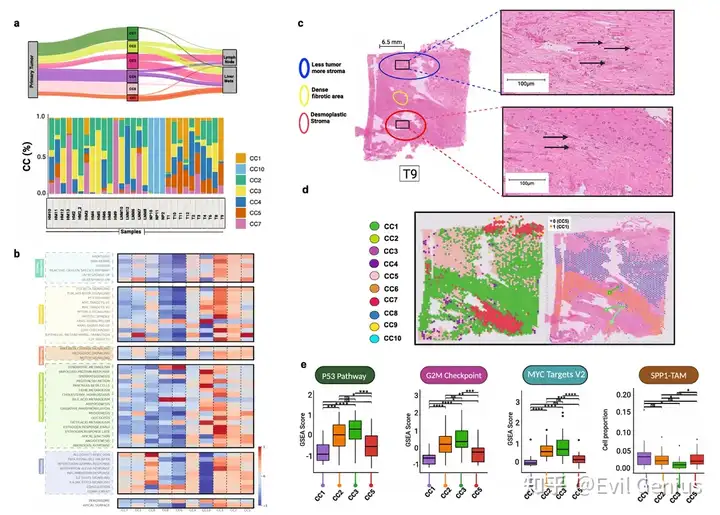
Результаты 4. Метаболическая перестройка и уязвимость (метаболические различия) рака поджелудочной железы.
- Эти результаты ясно описывают пространственно-зависимую метаболическую гетерогенность TME при PDAC.

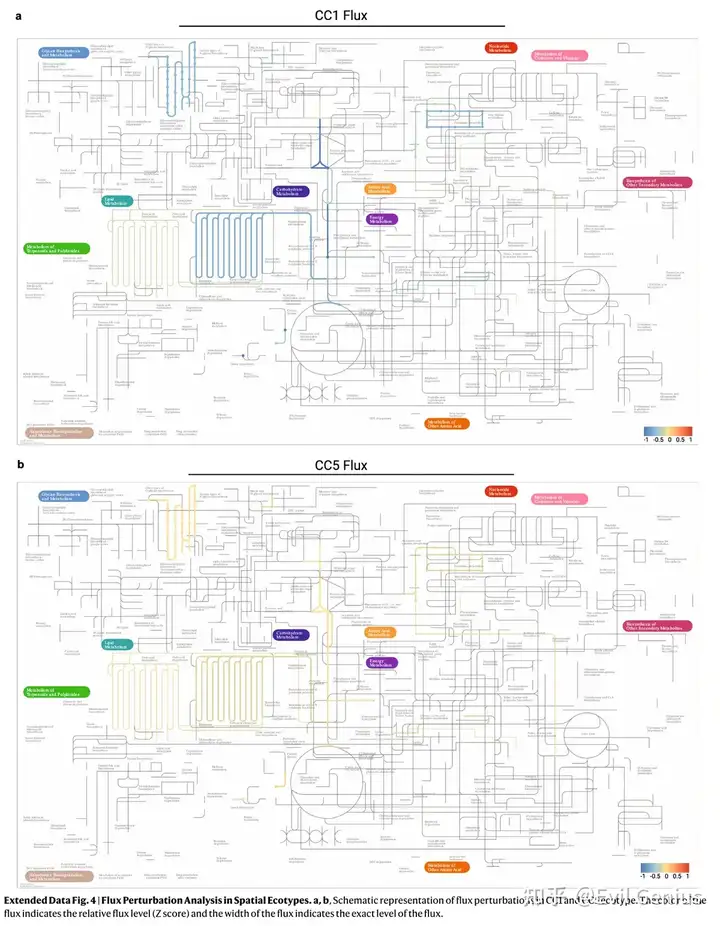
Результаты 5. Иммунный пространственный ландшафт на краю опухоли.
- Исследование образцов PDAC в первичных и метастатических образцах поджелудочной железы выявило значительно повышенную инфильтрацию иммунных клеток по сравнению с нормальными образцами поджелудочной железы.
- Перенесенные клетки перестраивают нормальные иммунные клетки лимфатических узлов и пополняют уникальные иммуносупрессивные структуры печени, обеспечивая иммунную толерантность опухоли.
Наконец, от пространственного расположения клеток к возникновению устойчивости к болезням
Жизнь хороша, с тобой еще лучше
Учебное пособие по Jetpack Compose для начинающих, базовые элементы управления и макет

Код js веб-страницы, фон частицы, код спецэффектов

【новый! Суперподробное】Полное руководство по свойствам компонентов Figma.
🎉Обязательно к прочтению новичкам: полное руководство по написанию мини-программ WeChat с использованием программного обеспечения Cursor.
[Забавный проект Docker] VoceChat — еще одно приложение для мгновенного чата (IM)! Может быть встроен в любую веб-страницу!

Как реализовать переход по странице в HTML (html переходит на указанную страницу)

Как решить проблему зависания и низкой скорости при установке зависимостей с помощью npm. Существуют ли доступные источники npm, которые могут решить эту проблему?

Серия From Zero to Fun: Uni-App WeChat Payment Practice WeChat авторизует вход в систему и украшает страницу заказа, создает интерфейс заказа и инициирует запрос заказа

Серия uni-app: uni.navigateЧтобы передать скачок значения

Апплет WeChat настраивает верхнюю панель навигации и адаптируется к различным моделям.

JS-время конвертации

Обеспечьте бесперебойную работу ChromeDriver 125: советы по решению проблемы chromedriver.exe не найдены

Поле комментария, щелчок мышью, специальные эффекты, js-код
Объект массива перемещения объекта JS

Как открыть разрешение на позиционирование апплета WeChat_Как использовать WeChat для определения местонахождения друзей
Я даю вам два набора из 18 простых в использовании фонов холста Power BI, так что вам больше не придется возиться с цветами!

Получить текущее время в js_Как динамически отображать дату и время в js

Вам необходимо изучить сочетания клавиш vsCode для форматирования и организации кода, чтобы вам больше не приходилось настраивать формат вручную.

У ChatGPT большое обновление. Всего за 45 минут пресс-конференция показывает, что OpenAI сделал еще один шаг вперед.
Copilot облачной разработки — упрощение разработки

Микросборка xChatGPT с низким кодом, создание апплета чат-бота с искусственным интеллектом за пять шагов

CUDA Out of Memory: идеальное решение проблемы нехватки памяти CUDA
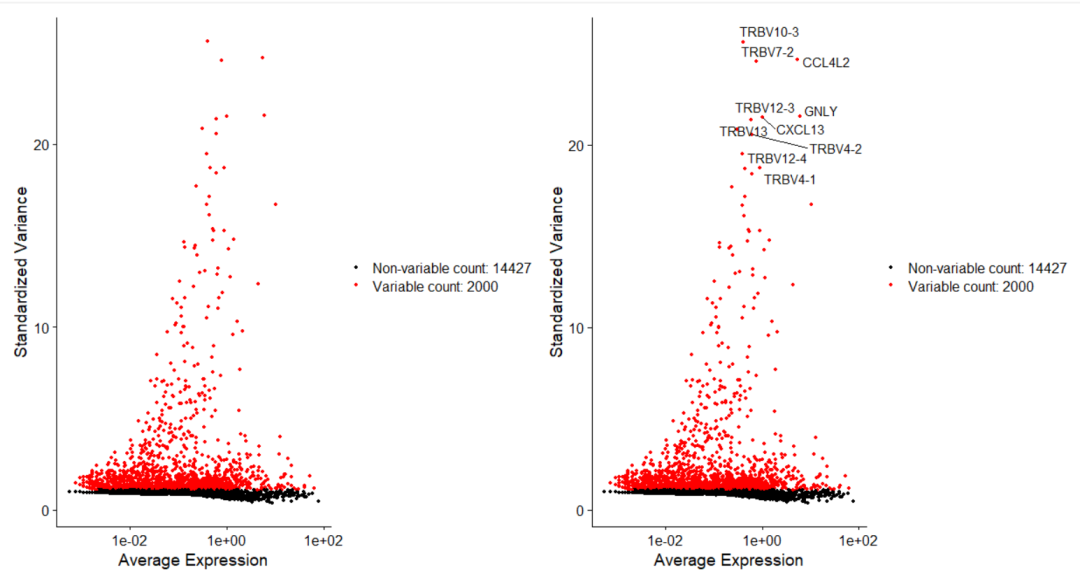
Анализ кластеризации отдельных ячеек, который должен освоить каждый&MarkerгенетическийВизуализация

vLLM: мощный инструмент для ускорения вывода ИИ

CodeGeeX: мощный инструмент генерации кода искусственного интеллекта, который можно использовать бесплатно в дополнение к второму пилоту.

Машинное обучение Реальный бой LightGBM + настройка параметров случайного поиска: точность 96,67%
Бесшовная интеграция, мгновенный интеллект [1]: платформа больших моделей Dify-LLM, интеграция без кодирования и встраивание в сторонние системы, более 42 тысяч звезд, чтобы стать свидетелями эксклюзивных интеллектуальных решений.
LM Studio для создания локальных больших моделей
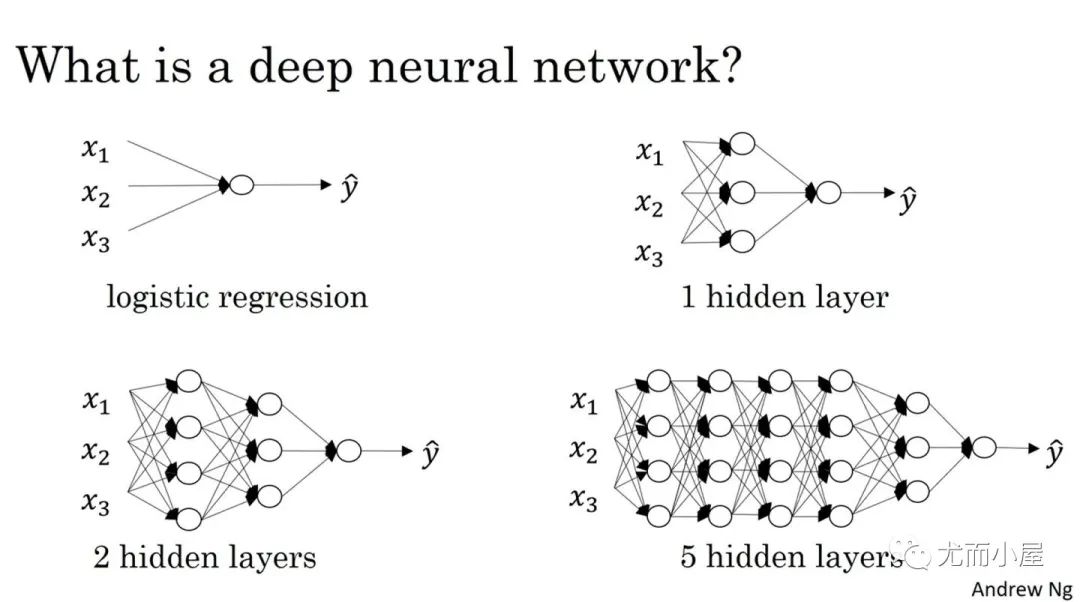
Как определить количество слоев и нейронов скрытых слоев нейронной сети?


