полный транскриптом | три поколенияполный транскриптоманалитический процесс (PacBio & ONT )-- Bambu
Сегодня мы продолжаем представлять инструмент для аннотирования и количественной оценки транскриптов с использованием трех поколений полноразмерных данных транскриптов. - Bambu。от Сингапурского агентства по науке, технологиям и исследованиям (A-STAR) изJonathan Göke(картина1)продолжительность разработкиRNA-seqИнструменты транскриптомного анализаBambu,Опубликовано в журнале «Nature Methods» 12 июня 2023 г.,НазваниеContext-aware transcript quantification from long-read RNA-seq data with Bambu。Этот инструмент основан на машинном обучении для идентификации и характеристики новых транскриптов.,Это позволяет проводить анализ адаптивности различных видов и образцов.

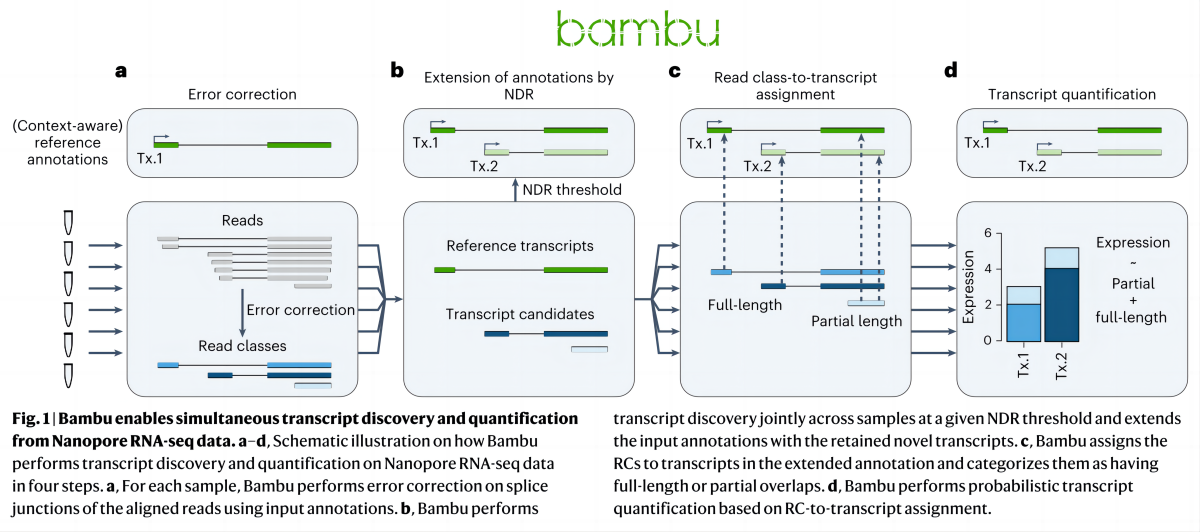
Однако большинство методов количественной оценки транскриптов основаны на файлах аннотаций фиксированных ссылок на гены;,Настоящие транскриптомы динамичны.,Надо судить по ситуации на данный момент.,Файлы статических аннотаций транскриптома содержат неактивные транскрипты (изоформы) некоторых генов.,иверно Некоторые гены имеют неполную аннотацию.。Bambu,Метод, использующий данные секвенирования длинной РНК.,Узнать Метод идентификации транскриптов на основе машинного обучения,Осуществите количественную оценку транскриптов в реальных данных секвенирования. Для выявления новых транскриптов,Bambu Предполагаемая скорость открытия новых discovery rate),объяснимый、Откалиброванный по точности отдельный параметр заменяет произвольный порог для одной выборки。Bambu Сохраняет полноразмерные и уникальные последовательности транскриптов в присутствии неактивных транскриптов (изоформ). может выполнить точную количественную оценку. По сравнению с существующими методами идентификации транскриптов,Bambu Повышенная точность достигается без потери чувствительности.。Динамическая аннотация, основанная на реальных данных, улучшает количественную оценку новых и известных транскриптов.。Воспользуйтесь преимуществом длительного чтенияRNAСеквенирование данных и машинное обучение,Bambu Облегчает точную идентификацию и количественную оценку транскриптов (рис. 2).

1. Введение в программное обеспечение
Bambu это Воспользуйтесь преимуществом длительного чтенияRNA-SeqДанные для идентификации и количественной оценки транскриптов в нескольких образцахпакет R。Выполнение сравнения последовательностейверноназад,Можно использоватьBambu Получите известные и новые транскрипты и уровни экспрессии генов.。Bambu Выходные данные можно использовать непосредственно для визуализации и последующего анализа, например, дифференциальной экспрессии генов или использования транскриптов.
Bambu Процесс анализа можно разделить на четыре этапа (рис. 3. a-d):первый,Использование вероятностной модели,Используйте справочные аннотации、Геномные последовательности и особенности, извлеченные из данных (подробные характеристики можно найти в разделе «Методы») для коррекции соотношения областей или сайтов соединения РНК. Исправленные последовательности, использующие один и тот же сайт разреза, были объединены в одну последовательность. (Read class, RCs)。Шаг 2,Интегрируйте объединенные последовательности из всех образцов (Читать классы), а также новый уровень открытий в выборках открытия, Чтение меньше). определенные порога. Последовательности класса NDR классифицируются как новые транскрипты.,и добавьте новую аннотированную расшифровку к аннотации эталонной расшифровки,Сформируйте библиотеку аннотаций на основе реальных образцов.(Расширенные оригинальные справочные примечания)。Шаг 3,Аннотация гена с использованием расширенной ссылки,Переклассифицируйте каждую последовательность классов Read и дайте ей название. в этом процессе,С тех порверно Неточные совпадения последовательностей, вызванные ошибками, можно исправить.。Шаг 4,Аннотация гена с использованием расширенной ссылки,верно Транскрипты в каждом образце для окончательного количественного определения,Получите матрицу экспрессии генов/транскриптов.
2. Установка программного обеспечения
Bambu: https://github.com/GoekeLab/bambu
Версия: v3.2.4
1. Установите Bambu с помощью Bioconductor.
существоватьRсередина,илиRstudio,илиRstudio-serverсредасередина Запустите следующую команду для установки,Установка завершена, как показано на рисунке 4.
if (!requireNamespace("BiocManager", quietly = TRUE)) install.packages("BiocManager") #Если BiocManager уже установлен, вы можете игнорировать эту строку команды
BiocManager::install("bambu")
предположение:потому чтополный транскриптом Объем данных обычно велик, а объем вычислений велик,Локальное программное обеспечение R, развернутое на обычном настольном компьютере или на вашем собственном ноутбуке.,Может занимать много памяти и вычислительных ресурсов.。предложение использовать сервер,развертывать Rstudio-server,Это подойдетсуществовать Хранение данных на сервереи Рассчитано。Специальная установкаразвертывать Пожалуйста, обратитесь к официальному сайту за инструкциями.:https://posit.co/download/rstudio-server/。
2. Проверьте установку Bambu.
Используйте встроенные тестовые данные, чтобы подтвердить успешную установку Bambu.
#Загрузка пакета бамбука
library(bambu)
#Выполните следующие команды, чтобы импортировать данные секвенирования, эталонный геном, файлы аннотаций эталонного генома и выполнить полный транскриптоманализировать
test.bam <- system.file("extdata", "SGNex_A549_directRNA_replicate5_run1_chr9_1_1000000.bam", package = "bambu") #Читаем данные секвенирования
fa.file <- system.file("extdata", "Homo_sapiens.GRCh38.dna_sm.primary_assembly_chr9_1_1000000.fa", package = "bambu") #Читаем эталонный геном
gtf.file <- system.file("extdata", "Homo_sapiens.GRCh38.91_chr9_1_1000000.gtf", package = "bambu") #Читаем эталонный файл аннотации гена
bambuAnnotations <- prepareAnnotations(gtf.file) #Предварительная обработка аннотаций эталонного генома
se <- bambu(reads = test.bam, annotations = bambuAnnotations,genome = fa.file) #полный транскриптоманализироватьПосле запуска последней строки мы получаем --- Start isoform quantification --- и--- Finished running Bambu ---,Это означает, что Bambu запущен и успешно установлен.
3. Использование программного обеспечения
Входной файл в режиме по умолчанию:
- пройтииэталонный геном Сравниватьвернофайл последовательности,
.bamФормат файла。 - эталонный файл аннотации гена,
.gtfдокумент。 - эталонный геномдокумент,
.faдокумент。
1. Подготовьте файлы последовательностей эталонного генома.
Потому что документация Bambu не предлагает лучшего метода, чем верный.,Поэтому здесь используется обычно используемая длина.(long-read)Сравниватьвернопрограммное обеспечениеminimap2。
#Выберите соответствующую команду запуска на основе платформы секвенирования третьего поколения и метода построения библиотеки, одноэтапного метода.
$ minimap2 -ax splice:hq -uf ref.fa iso-seq.fq | samtools sort -@ 12 -o align.bam --write-index - # PacBio Iso-seq/traditional cDNA
$ minimap2 -ax splice ref.fa nanopore-cdna.fa | samtools sort -@ 12 -o align.bam --write-index - # Nanopore 2D cDNA-seq
$ minimap2 -ax splice -uf -k14 ref.fa direct-rna.fq | samtools sort -@ 12 -o align.bam --write-index - # Nanopore Direct RNA-seq
#Пошаговый пример
$ minimap2 -ax splice:hq -uf ref.fa iso-seq.fq | samtools view -@ 12 -bS | samtools sort -@ 12 -o align.bam # PacBio Iso-seq/traditional cDNA
$ minimap2 -ax splice ref.fa nanopore-cdna.fa | samtools view -@ 12 -bS | samtools sort -@ 12 -o align.bam # Nanopore 2D cDNA-seq
$ minimap2 -ax splice -uf -k14 ref.fa direct-rna.fq | samtools view -@ 12 -bS | samtools sort -@ 12 -o align.bam # Nanopore Direct RNA-seq
#вернобам Индексация файлов
$ samtools index align.bamУведомление:
- PacBioплатформаиONTДанные, генерируемые платформой,Конкретные параметры различаются,Подробности см. в документации по использованию minimap2.
- Используемый здесь эталонный геном должен быть унифицирован с геномом, использованным Бамбу.
- Нужно заранее установить
samtools,Обратите внимание на установленную версию. - потому чтоminimap2Результат:
.samФормат файла,Так что используйтеsamtoolsВоля.samпреобразован в.bam,и использоватьsamtools sortверно.bamСортировать,Ранназадиспользоватьsamtools indexиндекс。Выше показан поворот в один шаг.bamи Передача шаг за шагом.bamПример。 samtools v1.18Версия--write-index -параметры;samtools v1.9Нет версии。
2. Прочтите файл .bam образца последовательности.
#Может читать несколько файлов примеров одновременно
samples <- c(S1.bam, S1.bam, S1.bam)3. Подготовьте файлы эталонного генома.
Если людии Мыши могутсуществоватьGencodeскачать,Если вы встретите другие виды, вы можете обратиться кEnsemblскачать。
4. Подготовка аннотации эталонного генома.
annotations <- prepareAnnotations( *.gft )
#Сохраняем файл комментариев как файл rds
saveRDS(annotations, ”/path/to/annotations.rds” )
#Прочитайте файл комментариев в следующий раз
annotations <- readRDS("/path/to/annotations.rds")5. Беги Бамбу
se <- bambu(reads = samples, annotations = annotations, genome = genome.fa)6. Выявляйте только новые транскрипты, а не оценивайте их количественно
se.discoveryOnly <- bambu(reads = samples, annotations = annotations, genome = genome.fa, quant = FALSE)7. Количественно оцениваются только известные трансгены и гены, новые транскрипты не идентифицируются.
se.quantOnly <- bambu(reads = samples, annotations = annotations, genome = genome.fa, discovery = FALSE)8. Сборка транскрипта независимо от ссылочной аннотации.
novelAnnotations <- bambu(reads = test.bam, annotations = NULL, genome = fa.file, NDR = 0.5, quant = FALSE)Для настройки конкретных параметров и отладки обратитесь к официальному GitHub.
4. Выходные файлы
Бамбу вернётSummarizedExperimentОбъект, доступ к которому можно получить через:
- assays(se) возвращает матрицу распространенности экспрессии транскриптов в форме количества или CPM.
- rowRanges(se) возвращает список GRangesList, содержащий все аннотированные и вновь обнаруженные транскрипты.
- rowData(se) возвращает дополнительную информацию для каждой расшифровки.
Извлеките выражение транскрипта, используя переменные (например, количество или CPM) в assays().:
- assays(se)$counts - количество подсчитанных выражений.
- assays(se)$CPM — экспрессия, нормализованная по глубине секвенирования.
- assays(se)$fullLengthCounts — выражение подсчета полноразмерных последовательностей каждого транскрипта.
- assays(se)$uniqueCounts — подсчет экспрессии уникальных последовательностей для каждого транскрипта.
Можно использоватьwriteBambuOutput()Выведите полный файл результатов. Эта команда может создать три файла: 1. Расширенный..gtfдокумент. 2. Подсчитайте матрицу экспрессии транскриптов. 3. Матрица экспрессии количества генов。
writeBambuOutput(se, path = "./bambu/")Если вас интересуют только новые расшифровки, вы можете отфильтровать справочные аннотированные расшифровки.
se.novel = se[mcols(se)$novelTranscript,]
writeBambuOutput(se.novel, path = "./bambu/")5. Визуализация
проходитьplotBambuГены/транскрипты можно визуализировать (рис. 5).。
plotBambu(se, type = "annotation", gene_id = "ENSG00000107104")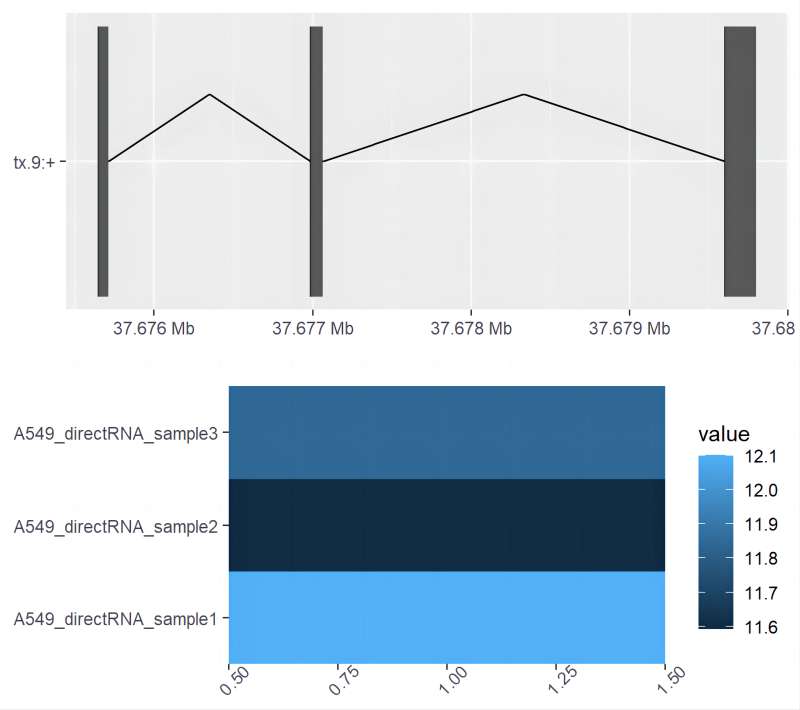
Структура и уровни экспрессии транскрипта tx.9 и других транскриптов соответствующих ему генов (рис. 6)。
plotBambu(se, type = "annotation", transcript_id = "tx.9")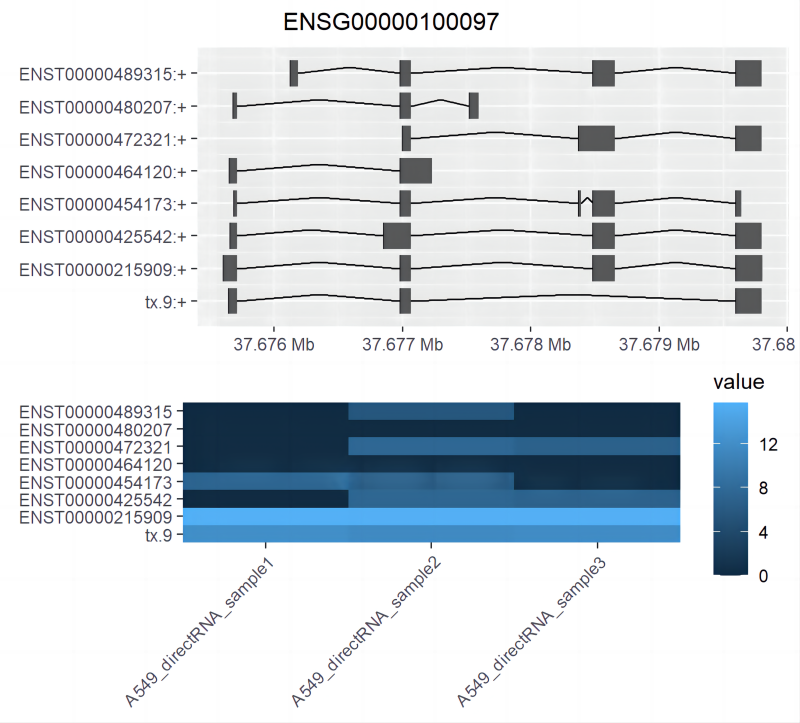
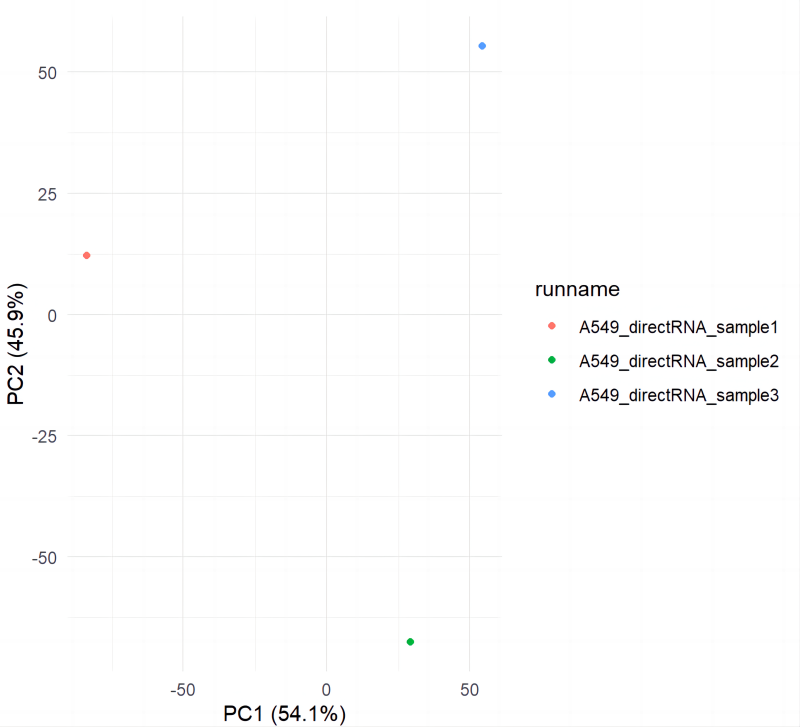
проходитьplotBambuОтображение примера группировки кластеров PCA (рис. 7)。
Ссылки
- Chen, Ying, et al. "Context-aware transcript quantification from long-read RNA-seq data with Bambu." Nature methods. (2023)
- Bambu github: https://github.com/GoekeLab/bambu
Учебное пособие по Jetpack Compose для начинающих, базовые элементы управления и макет

Код js веб-страницы, фон частицы, код спецэффектов

【новый! Суперподробное】Полное руководство по свойствам компонентов Figma.
🎉Обязательно к прочтению новичкам: полное руководство по написанию мини-программ WeChat с использованием программного обеспечения Cursor.
[Забавный проект Docker] VoceChat — еще одно приложение для мгновенного чата (IM)! Может быть встроен в любую веб-страницу!

Как реализовать переход по странице в HTML (html переходит на указанную страницу)

Как решить проблему зависания и низкой скорости при установке зависимостей с помощью npm. Существуют ли доступные источники npm, которые могут решить эту проблему?

Серия From Zero to Fun: Uni-App WeChat Payment Practice WeChat авторизует вход в систему и украшает страницу заказа, создает интерфейс заказа и инициирует запрос заказа

Серия uni-app: uni.navigateЧтобы передать скачок значения

Апплет WeChat настраивает верхнюю панель навигации и адаптируется к различным моделям.

JS-время конвертации

Обеспечьте бесперебойную работу ChromeDriver 125: советы по решению проблемы chromedriver.exe не найдены

Поле комментария, щелчок мышью, специальные эффекты, js-код
Объект массива перемещения объекта JS

Как открыть разрешение на позиционирование апплета WeChat_Как использовать WeChat для определения местонахождения друзей
Я даю вам два набора из 18 простых в использовании фонов холста Power BI, так что вам больше не придется возиться с цветами!

Получить текущее время в js_Как динамически отображать дату и время в js

Вам необходимо изучить сочетания клавиш vsCode для форматирования и организации кода, чтобы вам больше не приходилось настраивать формат вручную.

У ChatGPT большое обновление. Всего за 45 минут пресс-конференция показывает, что OpenAI сделал еще один шаг вперед.
Copilot облачной разработки — упрощение разработки

Микросборка xChatGPT с низким кодом, создание апплета чат-бота с искусственным интеллектом за пять шагов

CUDA Out of Memory: идеальное решение проблемы нехватки памяти CUDA
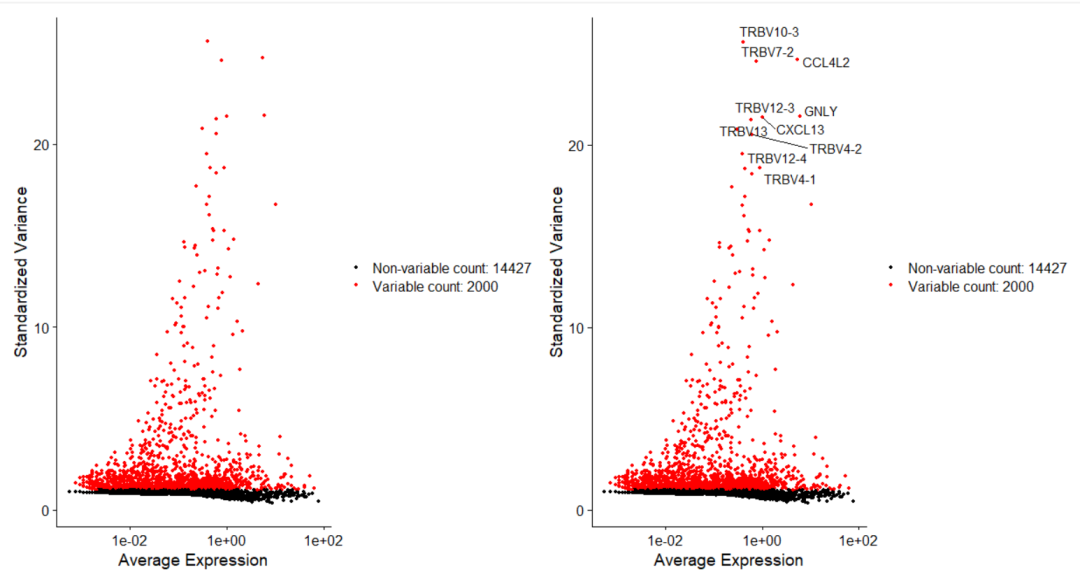
Анализ кластеризации отдельных ячеек, который должен освоить каждый&MarkerгенетическийВизуализация

vLLM: мощный инструмент для ускорения вывода ИИ

CodeGeeX: мощный инструмент генерации кода искусственного интеллекта, который можно использовать бесплатно в дополнение к второму пилоту.

Машинное обучение Реальный бой LightGBM + настройка параметров случайного поиска: точность 96,67%
Бесшовная интеграция, мгновенный интеллект [1]: платформа больших моделей Dify-LLM, интеграция без кодирования и встраивание в сторонние системы, более 42 тысяч звезд, чтобы стать свидетелями эксклюзивных интеллектуальных решений.
LM Studio для создания локальных больших моделей
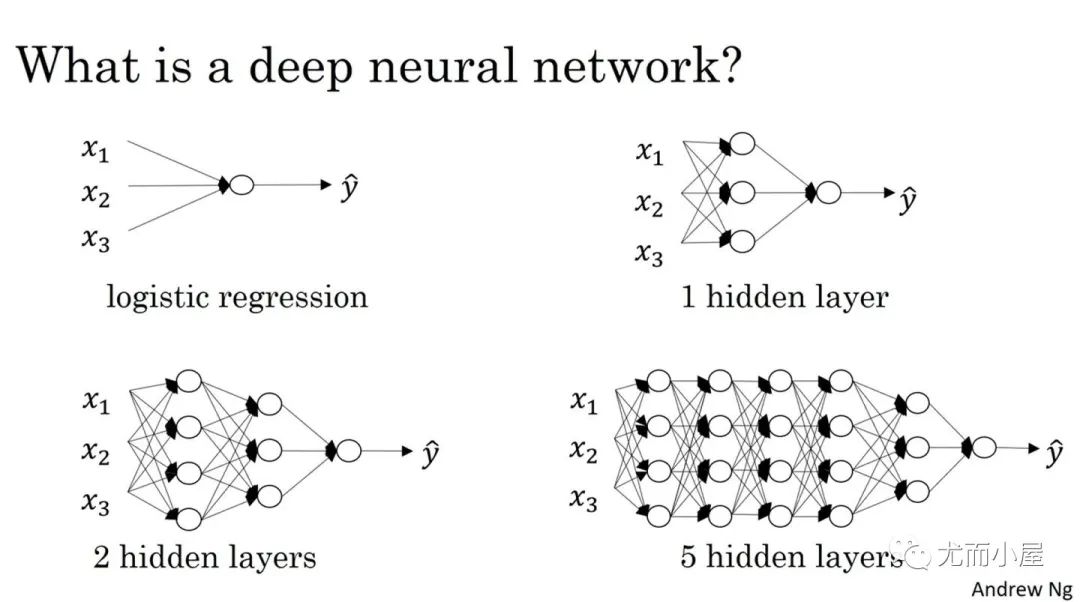
Как определить количество слоев и нейронов скрытых слоев нейронной сети?


